
类器官药物筛选服务
一、类器官药物筛选简介
长期以来药物研发过程低效、缓慢且昂贵。据统计,2021 年开发一款新药的平均成本降至近七年最低,仍高达约20亿美元。在肿瘤治疗药物研发方面,经过临床前研究开发的药物中,只有 5% 能够在临床试验中展现出效果。以上痛点,主要由于当前临床前模型并不能准确预测人体反应,在异质性和免疫微环境等方面表现欠佳,使得临床前和临床的结果无明确相关性。
传统的标志物筛选和评价主要依赖于 2D 培养的细胞模型和患者来源的异种移植(PDX)模型。但 2D 培养细胞在进行药效评估方面存在一定的局限性,动物模型存在实验周期长、成本高、不能高通量筛选等问题。患者来源的肿瘤类器官 (Patient derived organoids, PDO) 作为研究肿瘤的新型工具,在保留肿瘤原有的生物学特征之外,还能够稳定的传代,因此,类器官可能会改变复杂而昂贵的临床药物研发过程。
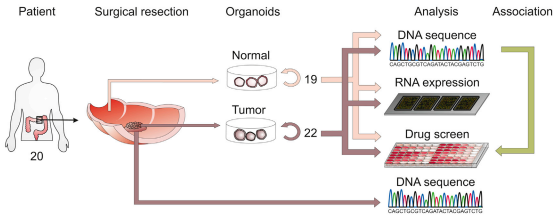
亘安生物携手丹望医疗提供的患者来源类器官(Patient derived organoidorganoid,PDO) 是一种新型的 3D 体外系统,可以直接从患者活检或切除的肿瘤中产生,因此它保留了患者体内肿瘤的形态学、基因组和病理生理学特征,并且具有相似的药理学特征和治疗反应,同时可进行大规模高通量筛选,可大幅度缩短临床前试验与临床试验的周期,提高准确度,降低新药开发成本与风险,提供新药开发临床前生物数据支持,为新药研发提供最优质的平台。
二、类器官药物筛选的应用
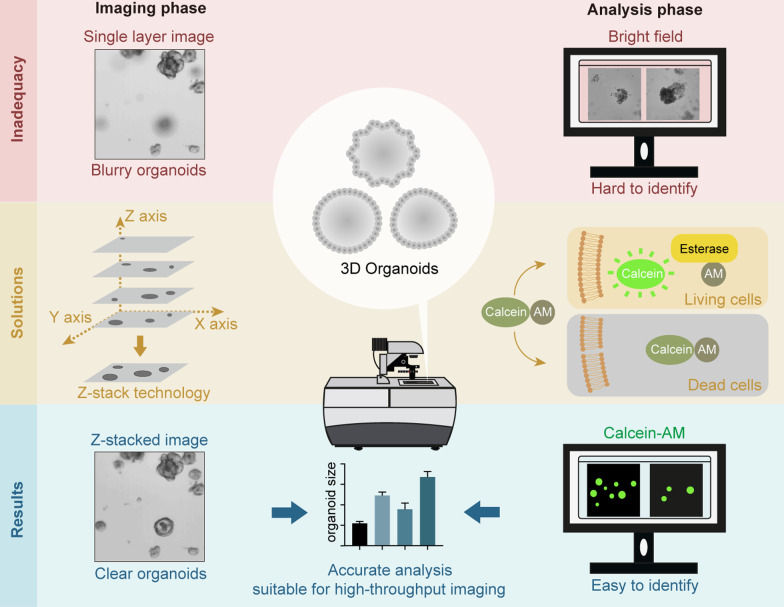
我们建立了以Z-stack 成像技术结合活细胞荧光染色方法为基础的高通量 类器官药物筛选平台。通过数十万张类器官影像数据构建AI 模型,并根据真实情况进行校准 。配合类器官自动化工作站可实现类器官培养及图像采集等全流程自动化操作。
应用案例:
1、小分子化疗药(盐酸伊立替康)疗效研究
我们对80 例肠癌类器官的药物测试中发现,用类器官预测药物疗效,其敏感性达78.01%,特异性91.97%。因此,类器官模型在化合物筛选中存在巨大优势。类器官模型在化合物的高通量筛选、浓度测试、耐药及安全性等方面,能够帮助研究者快速获得更敏感、更安全的抗肿瘤药物。
肠癌类器官构建成功后,使用小分子化疗药伊立替康处理,培养10 天后发现,与对照组相比,伊立替康处理后的类器官大小与初始大小无显著差异,且出现了大量的细胞死亡,而对照组类器官没有用药物处理,类器官出现了明显的增长。
2、抗体-药物偶联物(ADC) 筛选及评价
目前,多家生物制药公司不断拓展ADC研发管线,而功能评价、成药性和开发成本则是ADC药研制胜的关键。因此,选用更快捷准确的功能评价模型,加速ADC药物研发的总体进程,成为了ADC赛道的助跑器。
五、服务优势
1、基于肿瘤类器官模型,可提供大分子药物、小分子药物、抗体-药物偶联物(ADC)的筛选及评价服务;
2、样本类型丰富,全测序,严格质控,临床信息完整可追溯;
3、多种实验方案可供选择,灵活;
4、高质量数据输出,标准化、自动化技术体系,最大程度保证过程稳定性;
5、AI辅助药敏检测系统,可自动完成计算与评估;
6、方便获取相关上下游服务。
参考文献
[1] Marc van de Wetering M, et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 2015;161(4):933-945.
[2] Shanqiang Qu. et al. Patient-derived organoids in human cancer: a platform for fundamental research and precision medicine. Mol Biomed, 2024 Feb 12;5(1):6.
[3] Xiaomeng Li, Guoxiang Fu, Long Zhang, et al. Assay establishment and validation of a high-throughput organoid-based drug screening platform. Stem Cell Res Ther., 2022, 13, 219.
[4] Yao et al., 2020, Cell Stem Cell 26, 1–10.
长期以来药物研发过程低效、缓慢且昂贵。据统计,2021 年开发一款新药的平均成本降至近七年最低,仍高达约20亿美元。在肿瘤治疗药物研发方面,经过临床前研究开发的药物中,只有 5% 能够在临床试验中展现出效果。以上痛点,主要由于当前临床前模型并不能准确预测人体反应,在异质性和免疫微环境等方面表现欠佳,使得临床前和临床的结果无明确相关性。
传统的标志物筛选和评价主要依赖于 2D 培养的细胞模型和患者来源的异种移植(PDX)模型。但 2D 培养细胞在进行药效评估方面存在一定的局限性,动物模型存在实验周期长、成本高、不能高通量筛选等问题。患者来源的肿瘤类器官 (Patient derived organoids, PDO) 作为研究肿瘤的新型工具,在保留肿瘤原有的生物学特征之外,还能够稳定的传代,因此,类器官可能会改变复杂而昂贵的临床药物研发过程。

亘安生物携手丹望医疗提供的患者来源类器官(Patient derived organoidorganoid,PDO) 是一种新型的 3D 体外系统,可以直接从患者活检或切除的肿瘤中产生,因此它保留了患者体内肿瘤的形态学、基因组和病理生理学特征,并且具有相似的药理学特征和治疗反应,同时可进行大规模高通量筛选,可大幅度缩短临床前试验与临床试验的周期,提高准确度,降低新药开发成本与风险,提供新药开发临床前生物数据支持,为新药研发提供最优质的平台。
二、类器官药物筛选的应用
我们建立了以Z-stack 成像技术结合活细胞荧光染色方法为基础的高通量 类器官药物筛选平台。通过数十万张类器官影像数据构建AI 模型,并根据真实情况进行校准 。配合类器官自动化工作站可实现类器官培养及图像采集等全流程自动化操作。
应用案例:
1、小分子化疗药(盐酸伊立替康)疗效研究
我们对80 例肠癌类器官的药物测试中发现,用类器官预测药物疗效,其敏感性达78.01%,特异性91.97%。因此,类器官模型在化合物筛选中存在巨大优势。类器官模型在化合物的高通量筛选、浓度测试、耐药及安全性等方面,能够帮助研究者快速获得更敏感、更安全的抗肿瘤药物。
 注:肠癌类器官在伊立替康处理10 天后的荧光显微镜照片,活细胞用钙黄绿素AM(绿色)染色,死细胞用碘化丙啶(PI)(红色)染色
注:肠癌类器官在伊立替康处理10 天后的荧光显微镜照片,活细胞用钙黄绿素AM(绿色)染色,死细胞用碘化丙啶(PI)(红色)染色
肠癌类器官构建成功后,使用小分子化疗药伊立替康处理,培养10 天后发现,与对照组相比,伊立替康处理后的类器官大小与初始大小无显著差异,且出现了大量的细胞死亡,而对照组类器官没有用药物处理,类器官出现了明显的增长。
2、抗体-药物偶联物(ADC) 筛选及评价
目前,多家生物制药公司不断拓展ADC研发管线,而功能评价、成药性和开发成本则是ADC药研制胜的关键。因此,选用更快捷准确的功能评价模型,加速ADC药物研发的总体进程,成为了ADC赛道的助跑器。
a.类器官对MTX-1000和DS-8201a的响应。显示了两个类器官的明场(左)和活/死细胞(右)的代表性图像。结肠癌类器官用MTX-1000或DS-8201a以50ug / ml的浓度处理六天。活细胞用钙黄绿素AM(绿色)染色,死细胞用碘化丙啶(PI)(红色)染色。比例尺,20 μM b.ADC处理第0天和第6天的类器官大小。使用DS-8201a或MTX-1000与类器官孵育六天。测量了存活的类器官大小。所示数据是来自两个独立测量± SE 的平均值。 c.ADC穿透类器官的定量分析。MTX-1000与DS-8201a的PI染色信号从类器官表面到核心的空间分布。
五、服务优势
1、基于肿瘤类器官模型,可提供大分子药物、小分子药物、抗体-药物偶联物(ADC)的筛选及评价服务;
2、样本类型丰富,全测序,严格质控,临床信息完整可追溯;
3、多种实验方案可供选择,灵活;
4、高质量数据输出,标准化、自动化技术体系,最大程度保证过程稳定性;
5、AI辅助药敏检测系统,可自动完成计算与评估;
6、方便获取相关上下游服务。
参考文献
[1] Marc van de Wetering M, et al. Prospective derivation of a living organoid biobank of colorectal cancer patients. Cell. 2015;161(4):933-945.
[2] Shanqiang Qu. et al. Patient-derived organoids in human cancer: a platform for fundamental research and precision medicine. Mol Biomed, 2024 Feb 12;5(1):6.
[3] Xiaomeng Li, Guoxiang Fu, Long Zhang, et al. Assay establishment and validation of a high-throughput organoid-based drug screening platform. Stem Cell Res Ther., 2022, 13, 219.
[4] Yao et al., 2020, Cell Stem Cell 26, 1–10.
