
类器官免疫共培养评价
一、类器官免疫共培养简介
肿瘤免疫治疗通过重新启动并维持肿瘤- 免疫循环,恢复机体正常的抗肿瘤免疫反应,从而达到控制与清除肿瘤的目的。包括免疫检查点抑制剂(PD-1/L1)、肿瘤疫苗、过继性细胞疗法(CAR-T,TILs 等)以及非特异性免疫调节剂。针对免疫检查点抑制剂的免疫疗法( 如PD-1/PD-L1、CTLA4 等) 在肿瘤治疗中取得了良好的表现,然而,过继性细胞疗法(CAR-T)对血液肿瘤的某些亚群产生了显著的临床反应,而CAR-T 细胞在实体瘤中的治疗效果仍然具有挑战性。肿瘤和免疫系统之间的动态相互作用以及患者之间的异质性,缺乏临床预测生物标志物等,仍然是确定免疫治疗的瓶颈,对免疫治疗相关制药和疗法,以及患者产生了高昂的费用和时间成本。
亘安生物携手丹望医疗类为您提供高品质的类器官免疫共培养研究分析服务,该体系可以保留患者的异质性,并保留了关键的肿瘤相关抗原,为相关药物的开发或临床相关标志物的筛选提供了仿生性更强的免疫共培养平台。
二、原理流程
我们的类器官免疫共培养平台,通过患者来源类器官和免疫细胞在体外重建免疫微环境,以测试各种免疫相关疗法,包括免疫检查点抑制剂、TILs 细胞和CAR-T 细胞等,适用于细胞治疗疗法,免疫检查点相关疗法等的临床前研究分析。
类器官免疫共培养平台提供的服务包括:
三、类器官免疫共培养的应用
类器官免疫共培养技术在医药研发中有重要的应用,主要包括:
应用案例:
1、嵌合抗原受体T细胞(CAR-T)药效及毒性评价
基于患者来源的配对类器官 ( 肿瘤类器官和正常类器官)的CAR-T(或CAR-NK)细胞共培养系统,评价嵌合抗原受体T 细胞对肿瘤细胞的杀伤能力。
2、肿瘤浸润淋巴细胞(TILs) 疗法评价
基于肿瘤浸润淋巴细胞(TILs)和肿瘤类器官共培养模型,在体外重建肿瘤免疫微环境,检测浸润淋巴细胞对肿瘤类器官的杀伤效果。评估TILs 对肿瘤的杀伤能力。
肿瘤免疫治疗通过重新启动并维持肿瘤- 免疫循环,恢复机体正常的抗肿瘤免疫反应,从而达到控制与清除肿瘤的目的。包括免疫检查点抑制剂(PD-1/L1)、肿瘤疫苗、过继性细胞疗法(CAR-T,TILs 等)以及非特异性免疫调节剂。针对免疫检查点抑制剂的免疫疗法( 如PD-1/PD-L1、CTLA4 等) 在肿瘤治疗中取得了良好的表现,然而,过继性细胞疗法(CAR-T)对血液肿瘤的某些亚群产生了显著的临床反应,而CAR-T 细胞在实体瘤中的治疗效果仍然具有挑战性。肿瘤和免疫系统之间的动态相互作用以及患者之间的异质性,缺乏临床预测生物标志物等,仍然是确定免疫治疗的瓶颈,对免疫治疗相关制药和疗法,以及患者产生了高昂的费用和时间成本。
亘安生物携手丹望医疗类为您提供高品质的类器官免疫共培养研究分析服务,该体系可以保留患者的异质性,并保留了关键的肿瘤相关抗原,为相关药物的开发或临床相关标志物的筛选提供了仿生性更强的免疫共培养平台。
二、原理流程
我们的类器官免疫共培养平台,通过患者来源类器官和免疫细胞在体外重建免疫微环境,以测试各种免疫相关疗法,包括免疫检查点抑制剂、TILs 细胞和CAR-T 细胞等,适用于细胞治疗疗法,免疫检查点相关疗法等的临床前研究分析。
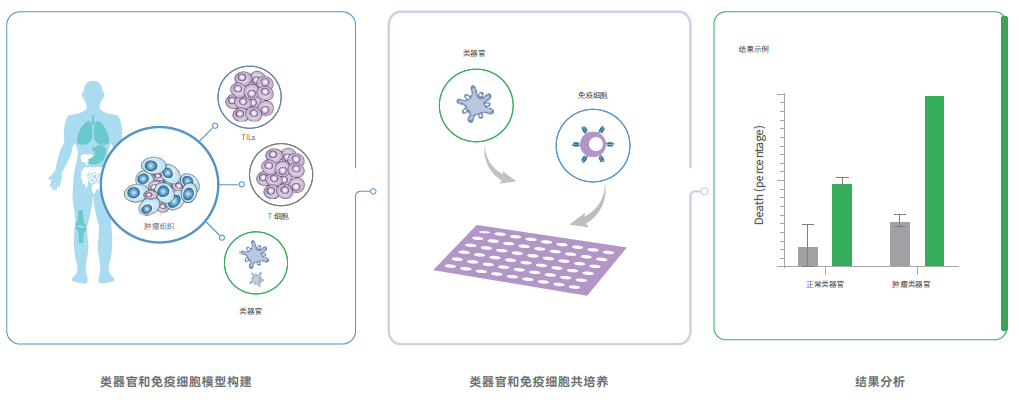
类器官免疫共培养平台提供的服务包括:
- 肿瘤类器官和配对的健康类器官模型;
- 肿瘤类器官杀伤分析;
- 细胞活力分析:类器官计数、面积统计;
- 标志物检测;
- 基因信息分析;
- 细胞因子分析;
- 实时成像;
- 免疫组织化学、免疫荧光等。
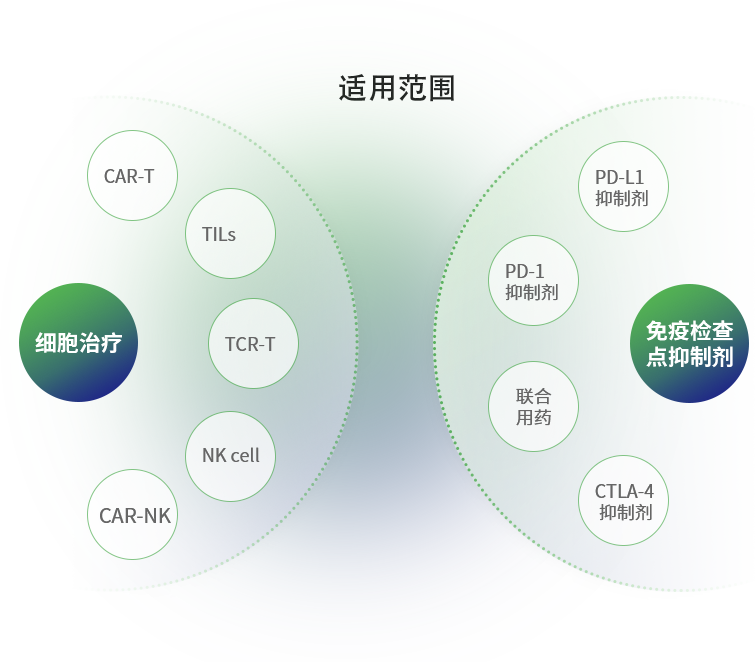
三、类器官免疫共培养的应用
类器官免疫共培养技术在医药研发中有重要的应用,主要包括:
- 免疫细胞杀伤力评估
- 免疫细胞增殖、分化评估
- 免疫细胞迁移、浸润分析
- 免疫检查点抑制剂测试
- 新生抗原鉴定
- 细胞治疗药效及毒性评价等
应用案例:
1、嵌合抗原受体T细胞(CAR-T)药效及毒性评价
基于患者来源的配对类器官 ( 肿瘤类器官和正常类器官)的CAR-T(或CAR-NK)细胞共培养系统,评价嵌合抗原受体T 细胞对肿瘤细胞的杀伤能力。
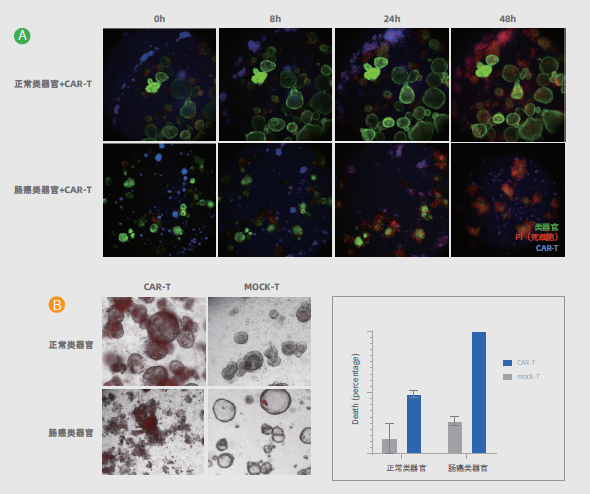
图1. CAR-T 对肠癌类器官的杀伤。A. 来源于同一患者的肠癌类器官和正常类器官分别与针对肿瘤相关抗原的CAR-T 细胞共培养,在不同时间点(0 小时,8 小时,24 小时,48 小)对同一位置进行图像采集。正常类器官在48 小时内形态正常,保持存活,肠癌类器官24 小时之后开始崩解,至48 小时完全死亡。绿色荧光标记活性类器官(内源性表达GFP),蓝色荧光标记CAR-T 细胞(cell trace violet 染料标记),红色荧光标记死细胞(PI 染料标记)。
B. 来源于同一患者的肠癌类器官和正常类器官分别与针对肿瘤相关抗原的CAR-T 及对照MOCK-T 细胞共培养,48 小时后进行图像采集。左:与CAR-T 细胞共培养的正常类器官在48 小时内形态正常,保持存活,而肠癌类器官48小时完全死亡。与MOCK-T细胞共培养的正常类器官和肠癌类器官均形态正常,保持存活。红色荧光标记死细胞(PI 染料标记)并叠加明场图像。右:对存活的类器官进行计数定量,计算类器官死亡率。
2、肿瘤浸润淋巴细胞(TILs) 疗法评价
基于肿瘤浸润淋巴细胞(TILs)和肿瘤类器官共培养模型,在体外重建肿瘤免疫微环境,检测浸润淋巴细胞对肿瘤类器官的杀伤效果。评估TILs 对肿瘤的杀伤能力。
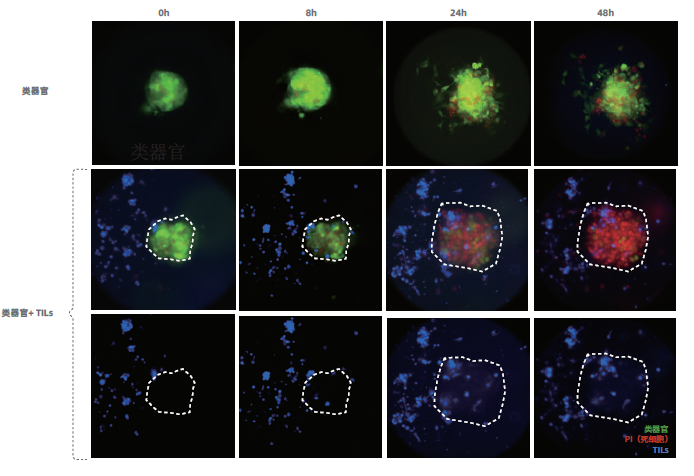
图2.TILs 对胃癌类器官的杀伤。来源于同一患者的胃癌类器官和肿瘤浸润淋巴细胞(TILs)共培养,在不同时间点(0 小时,8 小时,24 小时,48 小时)对同一位置进行图像采集。未加TILs 的胃癌类器官在48 小时内保持存活,而加入TILs 的胃癌类器官24 小时之后开始大量死亡。白色虚线圈住部分为同一胃癌类器官的位置,显示TILs 逐渐浸润胃癌类器官内部。绿色荧光标记活性类器官(内源性表达GFP),蓝色荧光标记TILs(cell trace violet 染料标记),红色荧光标记死细胞(PI 染料标记)。
