
细胞系基因编辑
细胞系基因编辑是一种在细胞系中进行的基因编辑技术。这种技术允许科学家在细胞的基因组中精确地添加、删除或更改DNA序列。这种能力对于研究基因功能、模拟疾病以及开发新的治疗方法都非常重要。利用CRISPR/Cas9技术,可以实现对特定细胞中的基因敲除、突变或敲入,用于研究基因功能、信号传导、疾病机理以及药物开发,也可以实现对特定细胞的标记。
二、原理流程
CRISPR/Cas9编辑系统是在sgRNA(约20nt,与靶基因序列互补)的引导下,Cas9特异性切割目标基因,造成DNA双链的断裂(double-strand DNA breaks,DSBs),从而引起生物体内的DNA损伤修复。这种修复作用主要包括两种途径,一种是利用非同源重组(NHEJ)的修复,即易错修复,可能造成基因组的随机插入或缺失突变,这种方式常导致靶基因失去功能,基因敲除就是利用该修复机制[1,2]。另一种是利用同源重组修复(HDR),即精准修复,借助外源引入一段与预期编辑位点上下游紧邻且高度同源的DNA修复模板(donor,可以是短单链DNA序列(ssDNA)或质粒)介导序列的替换或插入,基因敲入和定点突变就是利用该修复机制[3]。
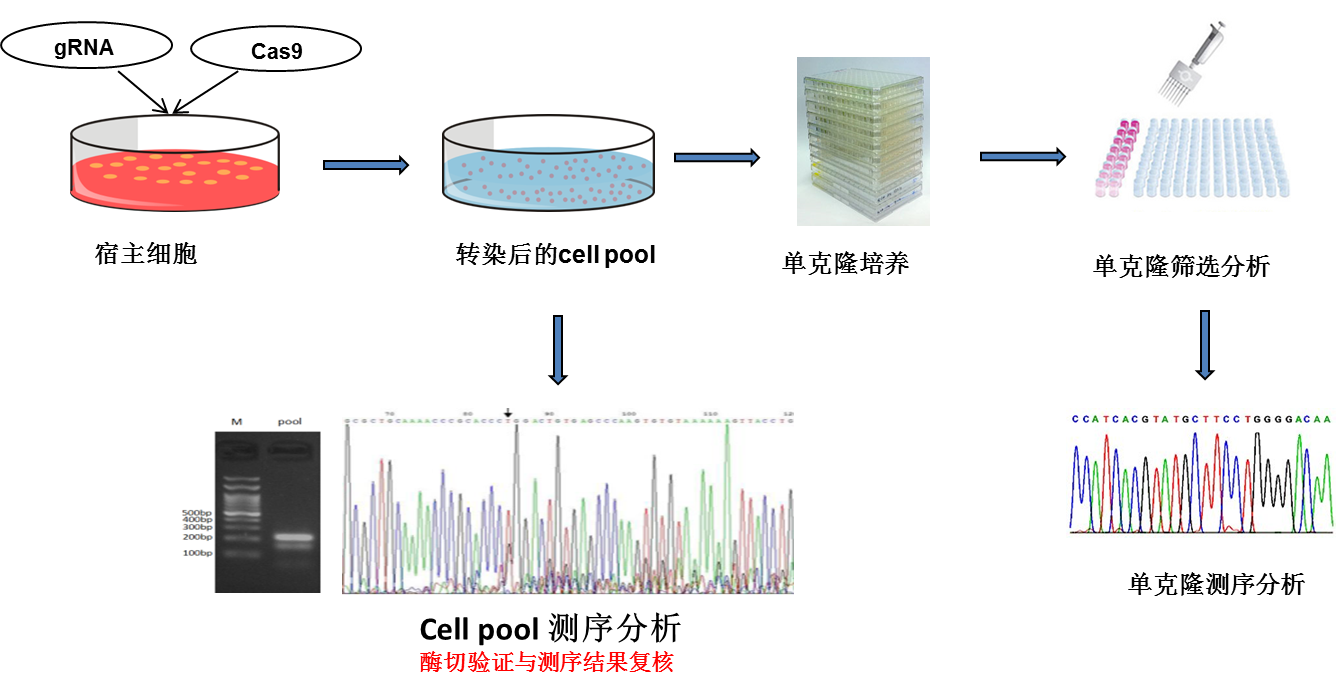
常见的基因敲除策略有两种,一种是单个sgRNA介导的基因敲除,通过CRISPR-Cas9系统在编码基因外显子产生的InDels造成基因移码突变,进而达到基因敲除的目的,此种基因敲除策略仅限于编码基因的敲除;另一种是两条sgRNA介导的基因敲除,通过两条sgRNA作用于目的片段两侧,实现目的片段序列删除,此种基因敲除策略不仅适用于编码基因,同样适用于非编码功能元件和ncRNA基因,这些非编码DNA序列无法通过移码突变方式达到功能失活的目的,必须依赖于功能片段的缺失。
三、细胞基因编辑的应用
1、基因移码突变敲除;
2、基因片段敲除;
3、基因定点突变;
4、基因敲入。
案例分享
案例1:CRISPR-Cas9 Mediated NOX4 Knockout Inhibits Cell Proliferation and Invasion in HeLa Cells.
活性氧(ROS)参与了多种作为细胞内信号分子的生物过程。NADPH氧化酶负责产生活性氧,NADPH氧化酶4(NOX4)是NOX/DUOX家族的成员,包括7种亚型(NOX1-5和DUOX 1-2),而NOX4是最丰富的亚型之一并广泛表达NOX异构体。 NOX4负责生产H2O2,NOX4在肾脏中的表达特别高。作者利用CRISPR技术对Hela细胞中的NOX4基因进行敲除[4]。

针对NOX4的3号外显子设计2条sgRNA序列,如下,gRNA #1:5’-CACCGGCACATGGGTAAAAGGATG-3’;gRNA #2 :5’-AAACTA TCCTTTTACCCATGTGCC-3’。sgRNA构建至 pX459 CRISPR/Cas9-Puro vector (Addgene, Cambridge, MA)。Hela细胞转染后的的PCR产物进行T7E1分析,使用Puro筛选阳性细胞,并分单克隆。测序结果和WB结果表明#1-2、#1-5、#1-6这三个克隆的NOX4基因均已成功敲除[4]。
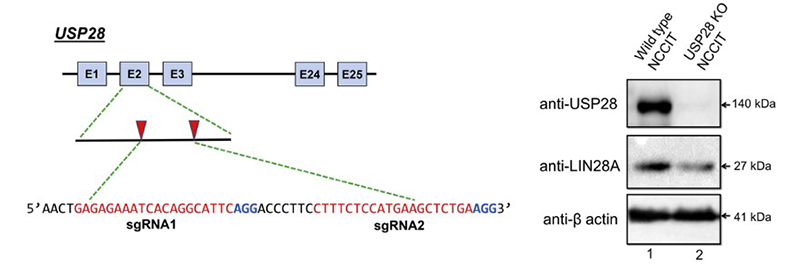
案例2:The stability and oncogenic function of LIN28A are regulated by USP28.
USP28基因为编码基因,一种去泛素化酶,通过与LIN28A蛋白相互作用并稳定其半衰期。USP28通过其去泛素化活性,逆转蛋白酶体降解作用,可拮抗LIN28A蛋白降解。通过在外显子2中设计两条sgRNA进行外显子2片段删除,实现对USP28基因功能的敲除,并验证了敲除后NCCIT细胞中LIN28A蛋白量降低[5]。
案例3:A high-throughput small molecule screen identifies farrerol as a potentiator of CRISPR/Cas9-mediated genome editing.
Safe harbor 位点是一种公认的对细胞或活体影响较小且敲入目的基因后能稳定表达的位点,目前常用的安全位点为AAVS1(人源)和Rosa26(鼠源),为便于阳性细胞克隆筛选,常规的做法是在敲入表达框内加入药物筛选标记,通过2A肽或其他linker连接进行非融合或融合表达,常见的药物筛选标记有Puro, Neo,BSD等。
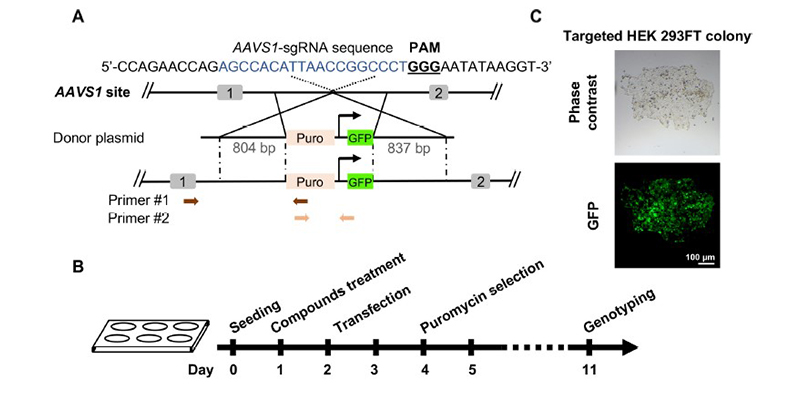
本案例中,通过CRISPR/Cas9系统介导非融合Puro和GFP敲入[6],Puro作用是去除大量无抗性的阴性细胞,通过puro筛选,可以确定外源基因敲入,并结合GFP荧光,可以确定puro和GFP功能序列正确敲入。理论上GFP本身就是一个筛选标记,但是由于敲入的低概率性,单纯的荧光筛选操作困难,引入puro筛选可以去除大量阴性细胞,简化后续单克隆筛选流程。
案例4:Analyses of point mutation repair and allelic heterogeneity generated by CRISPR/Cas9 and single stranded DNA oligonucleotides.
K562细胞中的β珠蛋白基因(beta globin gene)是基因编辑的公认且众所周知的靶标,特别是关于镰状细胞病。 β珠蛋白基因的第六个外显子中的突变与镰状细胞病的发作有关(镰状细胞中为A,野生型细胞为T),作者通过基因编辑手段模拟该发病过程。作者选择了脱靶率低的sgRNA序列。并标注了其产生的DNA双链断裂(DSB)位置,设计了72nt的ssDNA模板,最终筛选得到的#22阳性克隆的基因型[7]。

四、交付内容
1、基因编辑后的单克细胞一株(纯合/杂合);
2、相关报告文件;
3、测序结果。
五、服务优势
1、可实现多个位点的同时编辑;
2、提供从sgRNA设计合成到细胞株筛选的一站式服务;
3、基因定点编辑效率高;
4、丰富的经验,提供从方案设计到编辑的完整高质量服务。
参考文献
[1] Nelly M. Cruz and Benjamin S. Freedman. CRISPR Gene Editing in the Kidney. Author manuscript, Am J Kidney Dis . 2018;71(6): 874–883.
[2] Hryhorowicz M, Lipinski D, Zeyland J, et al. CRISPR/Cas9 immune system as a tool for genome engineering. Arch Immunol.2017;65(3):233–240.
[3] Savi´c, N.; Schwank, G. Advances in therapeutic CRISPR/Cas9 genome editing. Transl. Res.2016; 168,15–21.
[4] Jafari N, Kim H, Park R, Li L, Jang M, Morris AJ et al. CRISPR-Cas9 mediated NOX4 knockout inhibits cell proliferation and invasion in HeLa cells. PLoS One.2017;12:e0170327.
[5] Haq S, Das S, Kim D H, et al. The stability and oncogenic function of LIN28A are regulated by USP28[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2019, 1865(3): 599-610.
[6] Zhang W, Chen Y, Yang J, et al. A high-throughput small molecule screen identifies farrerol as a potentiator of CRISPR/Cas9-mediated genome editing[J]. Elife, 2020, 9:e56008.
[7] Bialk, P., B. Sansbury, N. Rivera-Torres, K. Bloh, D. Man and E. B. Kmiec. Analyses of point mutation repair and allelic heterogeneity generated by CRISPR/Cas9 and single-stranded DNA oligonucleotides. Sci Rep. 2016;6: 32681.
